
Cuprins:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Modificat ultima dată 2025-01-22 17:08.
Concepte cheie
- 1 mol de orice substanță conține 6,022 × 1023 particule .
- 6.022 × 1023 este cunoscut sub numele de Avogadro Număr sau Avogadro Constant și i se dă simbolul NA (1)
- N = n × NA N = numărul de particule în substanță.
- Pentru a găsi numărul de particule , N, într-o substanță:
- Pentru a găsi Cantitate de substanță în moli, n:
Ținând cont de acest lucru, cum găsiți numărul de particule dizolvate?
Înmulțiți cu cel al lui Avogadro Număr Înmulțiți valoarea obținută în Pasul 3 cu cea a lui Avogadro număr , care reprezintă număr de reprezentant particule într-o aluniță. a lui Avogadro număr are o valoare de 6,02 x 10^23. Continuând exemplul, 2 moli de apă x 6,02 x 10^23 particule pe mol = 1,20 x 10^24 particule.
Alături de mai sus, ce înseamnă numărul de particule? The numărul de particule (sau numărul de particule ) a unui sistem termodinamic, indicat în mod convențional cu litera N, este numărul de constituent particule în acel sistem. The numărul de particule este un parametru fundamental în termodinamică care este conjugat cu potențialul chimic.
În mod corespunzător, cum găsiți numărul de particule într-un mol?
Numărul lui Avogadro este o relație foarte importantă de reținut: 1 mol = 6.022×1023 6.022 × 10 23 atomi , molecule , protoni etc. Pentru a converti din alunițe la atomi , înmulțiți cantitatea molară cu numărul lui Avogadro. Pentru a converti din atomi la alunițe , împărțiți cantitatea de atom cu numărul lui Avogadro (sau înmulțiți cu reciproca acestuia).
Câte particule sunt în 3 moli?
În chimie și fizică, constanta Avogadro este numărul de constituenți particule , obișnuit atomi sau molecule , care sunt conținute în cantitatea de substanță dată de unul cârtiță și este egal cu 6,02 x 10**23. Asa de 3 alunițe de carbon atomi ar fi 18,06 x 10**23.
Recomandat:
Cu ce numărul atomic este egal cu numărul?

Numărul atomic identifică în mod unic un element chimic. Este identic cu numărul de încărcare al nucleului. Într-un atom neîncărcat, numărul atomic este, de asemenea, egal cu numărul de electroni. Suma numărului atomic Z și a numărului de neutroni N dă numărul de masă A unui atom
Ce particule contribuie la numărul de masă și care nu?

Ce particule contribuie la numărul de masă și care nu? De ce? Electronii nu afectează numărul de masă, dar neutronii și protonii o fac. Electronii nu au masă
Care este numărul de particule subatomice dintr-un atom de B 11?

Atunci numărul de masă este total protoni plus neutroni. Pentru bor-11 acest total este 11, iar cinci dintre particule sunt protoni, deci 11−5=6 neutroni
Ce este numărul natural și numărul întreg cu exemplu?
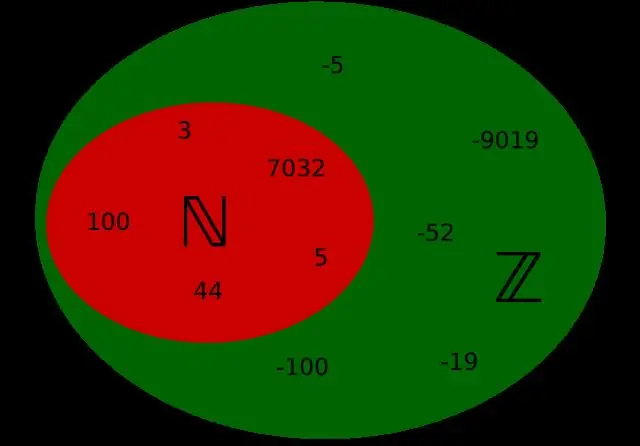
Numerele naturale sunt toate numerele 1, 2, 3, 4… Sunt numerele pe care le numărați de obicei și vor continua la infinit. Numerele întregi sunt toate numere naturale, inclusiv 0, de ex. 0, 1, 2, 3, 4… Numerele întregi includ toate numerele întregi și omologul lor negativ, de ex.
Care este numărul de masă și numărul atomic?

Numărul de masă (reprezentat prin litera A) este definit ca numărul total de protoni și neutroni dintr-un atom. Luați în considerare tabelul de mai jos, care prezintă date din primele șase elemente ale tabelului periodic. Luați în considerare elementul heliu. Numărul său atomic este 2, deci are doi protoni în nucleu
