
Cuprins:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Modificat ultima dată 2025-01-22 17:08.
Tampon
- Dacă ai doar un slab acid . Determinați concentrația acid (presupunând că nu există disociere). Căutați sau determinați KA.
- Dacă ai un slab acid ȘI conjugatul baza . Rezolva pentru tampon.
- Dacă ai doar conjugatul baza . Rezolva pentru pH-ul baza folosind Kb și ecuația hidrolizei.
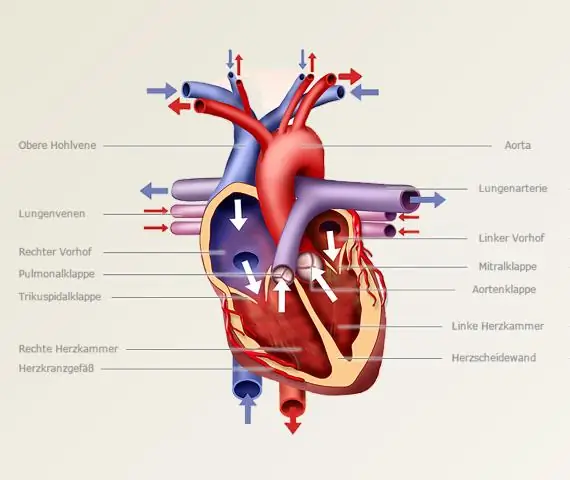
În consecință, cum se face titrarea acid-bază?
Procedura de titrare
- Clătiți biureta cu soluția standard, pipeta cu soluția necunoscută și balonul conic cu apă distilată.
- Puneți un volum măsurat cu precizie de analit în balonul Erlenmeyer folosind pipeta, împreună cu câteva picături de indicator.
La fel, cum se calculează titrarea? Folosește formula de titrare . Dacă titrantul și analitul au un raport molar de 1:1, formulă este molaritatea (M) al acidului x volumul (V) al acidului = molaritatea (M) al bazei x volumul (V) al bazei. ( Molaritatea este concentraţie a unei soluții exprimat ca număr de moli de substanță dizolvată pe litru de soluție.)
În plus, este F o bază puternică sau slabă?
Prin urmare, eu- este cel mai stabil și mai puțin de bază, în timp ce F - este cel mai puțin stabil și cel mai elementar. Baze puternice interactioneaza complet cu puternic acizi precum HCl pentru a forma o sare și apă într-o reacție de neutralizare. Alte baze puternice sunt oxizi solubili, cum ar fi Na2O și săruri hidroxid solubile. Baze puternice sunt puternic electroliti.
Pentru ce se folosește titrarea?
A titrare este o tehnică în care o soluție de concentrație cunoscută este folosit pentru determinați concentrația unei soluții necunoscute. De obicei, titrantul (soluția cunoscută) este adăugată dintr-o biuretă la o cantitate cunoscută de analit (soluția necunoscută) până când reacția este completă.
Recomandat:
Care sunt pașii implicați în galvanizarea?

Următoarele descriu pașii parcurși într-un proces tipic de galvanizare cu zinc. Pasul 1 - Curățarea substratului. Pasul 2 – Activarea substratului. Pasul 3 – Prepararea soluției de placare. Pasul 4 – Galvanizarea cu zinc. Pasul 5 – Clătire și uscare
Care sunt pașii pentru a reprezenta grafic o funcție?
Pași pentru schițarea graficului funcției Determinați dacă funcția este obținută prin transformarea unei funcții mai simple și efectuați pașii necesari pentru această funcție mai simplă. Determinați dacă funcția este pară, impară sau periodică. Găsiți intersecția cu y (punctul). Găsiți intersecția cu x (punctele în care). Găsiți ce asimptote are funcția, dacă există
Care sunt pașii pentru rezolvarea problemelor de cuvinte?
Pași simpli pentru rezolvarea problemelor cu cuvinte Citiți problema. Începeți prin a citi problema cu atenție. Identificați și enumerați faptele. Aflați exact ce cere problema. Eliminați excesul de informații. Acordați atenție unităților de măsură. Desenați o diagramă. Găsiți sau dezvoltați o formulă. Consultați o referință
Care sunt pașii pentru rezolvarea inegalităților în doi pași?

Este nevoie de doi pași pentru a rezolva o ecuație sau o inegalitate care are mai multe operații: Simplificați folosind inversul adunării sau scăderii. Simplificați în continuare folosind inversul înmulțirii sau împărțirii
Care sunt pașii pentru a separa nisipul și apa?

Când se adaugă nisip în apă, acesta fie atârnă în apă, fie formează un strat în partea de jos a recipientului. Prin urmare, nisipul nu se dizolvă în apă și este insolubil. Este ușor să separați nisipul și apa prin filtrarea amestecului. Sarea poate fi separată dintr-o soluție prin evaporare
