
Cuprins:
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- Modificat ultima dată 2025-01-22 17:08.
În numărul de oxidare metoda, determinați numerele de oxidare a tuturor atomilor. Apoi înmulțiți atomii care s-au schimbat cu un întreg mic numere . Faceți pierderea totală de electroni egală cu câștigul total de electroni. Atunci tu echilibru restul atomilor.
În consecință, cum echilibrați ecuațiile de reducere a oxidării?
Urmați aceste reguli pentru a echilibra ecuațiile redox simple:
- Scrieți semireacțiile de oxidare și reducere pentru specia care este redusă sau oxidată.
- Înmulțiți semireacțiile cu numărul corespunzător, astfel încât acestea să aibă un număr egal de electroni.
- Adăugați cele două ecuații pentru a anula electronii.
În al doilea rând, cum echilibrați ecuațiile? Metoda 1 Efectuarea unui echilibru tradițional
- Scrieți ecuația dată.
- Scrieți numărul de atomi pe element.
- Economisiți hidrogen și oxigen pentru final, deoarece acestea sunt adesea pe ambele părți.
- Începeți cu elemente individuale.
- Utilizați un coeficient pentru a echilibra un singur atom de carbon.
- În continuare, echilibrați atomii de hidrogen.
- Echilibrează atomii de oxigen.
De asemenea, cum echilibrați cu ușurință ecuațiile chimice?
În general, pentru a echilibra o ecuație, iată ce trebuie să facem:
- Numărați atomii fiecărui element din reactanți și produși.
- Utilizați coeficienți; așezați-le în fața compușilor după cum este necesar.
Este C o2co2 o reacție redox?
Este c + O2 = CO2 un intramolecular reactie redox sau nu? Un reactant (carbonul) este oxidat, iar celălalt (oxigenul) este redus. Deci, acesta este un simplu intermolecular reactie redox . Orice reacţie în care unul sau mai mulți reactanți/produși se întâmplă să fie elemente pure trebuie să fie a reactie redox.
Recomandat:
De ce ajustăm coeficienții atunci când echilibrăm ecuațiile chimice și nu indicele?

Când schimbi coeficienții, schimbi doar numărul de molecule ale acelei substanțe. Cu toate acestea, atunci când schimbați indicele, schimbați substanța în sine, ceea ce va face ca ecuația dvs. chimică să fie greșită
Ce sunt numerele naturale numerele întregi și numerele raționale?
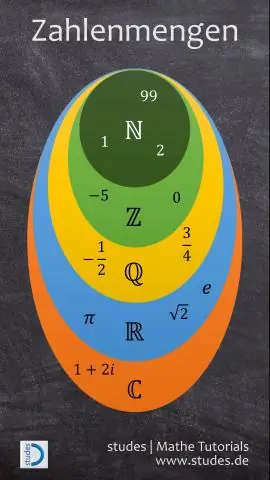
Numerele reale sunt clasificate în principal în numere raționale și iraționale. Numerele raționale includ toate numerele întregi și fracțiile. Toate numerele întregi negative și numerele întregi alcătuiesc mulțimea numerelor întregi. Numerele întregi cuprind toate numerele naturale și zero
Care număr nu este comun între numerele naturale și numerele întregi?

Zero nu are o valoare pozitivă sau negativă. Cu toate acestea, zero este considerat un număr întreg, ceea ce, la rândul său, îl face un număr întreg, dar nu neapărat un număr natural
Cum rezolvi numerele complexe și numerele imaginare?

Numerele complexe au forma a+bi a + b i, unde a și b sunt numere reale și i este rădăcina pătrată a lui −1. Toate numerele reale pot fi scrise ca numere complexe prin setarea b=0. Numerele imaginare au forma bi și pot fi scrise și ca numere complexe prin stabilirea a=0
Cum echilibrați exemplele de ecuații chimice?

Exemple de 10 ecuații chimice echilibrate Scrierea ecuațiilor chimice echilibrate este esențială pentru clasa de chimie. 6 CO2 + 6 H2O → C6H12O6 + 6 O2 (ecuație echilibrată pentru fotosinteză) 2 AgI + Na2S → Ag2S + 2 NaI. Ba3N2 + 6 H2O → 3 Ba(OH)2 + 2 NH3 3 CaCl2 + 2 Na3PO4 → Ca3(PO4)2 + 6 NaCl. 4 FeS + 7 O2 → 2 Fe2O3 + 4 SO2
