
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Modificat ultima dată 2025-01-22 17:08.
Teoria coliziunii , teorie folosit pentru a prezice ratele de reacții chimice , în special pentru gaze. The teoria coliziunii se bazează pe presupunerea că pentru a reacţie pentru a apărea este necesar ca speciile care reacţionează (atomi sau molecule) să se reunească sau se ciocnesc unul cu altul.
Mai mult, care sunt cele 3 părți ale teoriei coliziunii?
Sunt Trei important părți la teoria coliziunii , că substanţele care reacţionează trebuie se ciocnesc , că trebuie se ciocnesc cu suficientă energie și că trebuie se ciocnesc cu orientarea corectă.
Se poate întreba, de asemenea, cum faci teoria coliziunii? Când un catalizator este implicat în coliziune între moleculele reactante, este necesară mai puțină energie pentru schimbarea chimică la lua loc și, prin urmare, mai mult ciocniri au suficientă energie pentru a avea loc o reacție. Prin urmare, viteza de reacție crește. Teoria coliziunii este strâns legată de cinetica chimică.
Cum explică teoria coliziunii viteza reacției chimice?
The teoria coliziunii spune ca reactie chimica apar numai dacă există ciocniri a nivelurilor corecte de energie între molecule și atomi. Rezultă că dacă moleculele se ciocnesc mai des că acest lucru va crește rată de reacţie . Cu cât temperatura este mai mare, cu atât moleculele și atomii au mai multă energie cinetică.
Ce este o coliziune reușită în chimie?
Moleculele trebuie se ciocnesc cu energie suficientă, cunoscută sub numele de energie de activare, astfel încât chimic legăturile se pot rupe. Moleculele trebuie se ciocnesc cu orientarea corespunzătoare. A coliziune care îndeplinește aceste două criterii și care are ca rezultat a chimic reacție, este cunoscută ca a coliziune reușită sau un coliziune efectivă.
Recomandat:
Care sunt reactanții reacțiilor dependente de lumină?

În fotosinteză, oxigenul, dioxidul de carbon, ATP și NADPH sunt reactanți. GA3P și apa sunt produse. În fotosinteză, clorofila, apa și dioxidul de carbon sunt reactanți
Care dintre următoarele trebuie îndeplinite pentru ca teoria coliziunii a vitezei de reacție să fie valabilă?

Care dintre următoarele trebuie îndeplinite pentru ca teoria coliziunii a vitezei de reacție să fie valabilă? - Moleculele care reacţionează trebuie să se ciocnească unele cu altele. - Moleculele trebuie să se ciocnească într-o orientare care poate duce la rearanjarea atomilor. -Moleculele care reacţionează trebuie să se ciocnească cu suficientă energie
Ce sunt simbolurile chimice și formulele chimice?
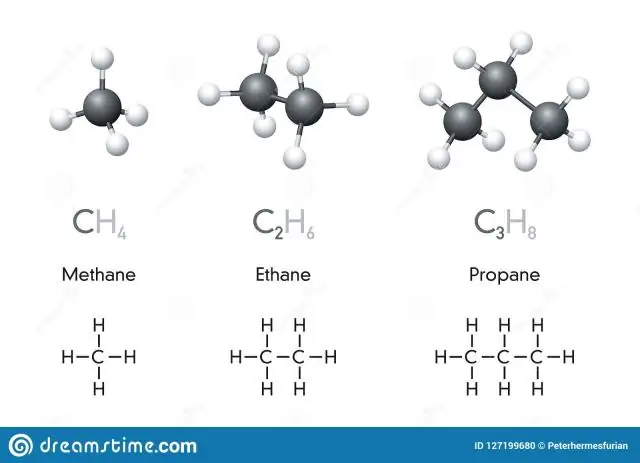
Un simbol chimic este o desemnare cu una sau două litere a unui element. Compușii sunt combinații de două sau mai multe elemente. O formulă chimică este o expresie care arată elementele dintr-un compus și proporțiile relative ale acelor elemente. Multe elemente au simboluri care derivă din numele latin al elementului
Care este funcția principală a reacțiilor luminoase ale fotosintezei?

Funcția generală a reacțiilor dependente de lumină, prima etapă a fotosintezei, este de a converti energia solară în energie chimică sub formă de NADPH și ATP, care sunt utilizate în reacții independente de lumină și alimentează asamblarea moleculelor de zahăr
Care este ordinea corectă a reacțiilor ciclului Calvin?

Carduri Termenul 1. Ce nu este necesar pentru reacțiile luminoase ale fotosintezei? Definiție Dioxid de carbon Termen 19. Care este ordinea corectă a reacțiilor ciclului Calvin-Benson? Definiție c. fixarea carbonului, sinteza G3P, regenerarea RuBP
