
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- Modificat ultima dată 2025-01-22 17:08.
De ce sunt separate cele două componente ale unei celule galvanice unul de altul? Metalele sunt așezate pe jumătate celule care sunt conectate printr-un pod de sare. Mișcarea electronilor de la anod la catod este curentul electric.
Aici, de ce sunt cele două componente ale celulei separate una de cealaltă?
Într-un galvanic celulă Sunt Două jumătate- celule . Fiecare jumătate- celulă conține un electrod într-un electrolit. The separare este necesar pentru a preveni contactul chimic direct al reacțiilor de oxidare și reducere, creând o diferență de potențial.
De asemenea, știți, pentru ce sunt folosite celulele galvanice? Celulele galvanice . Printre altele celule , A galvanic celula este un tip de electrochimic celulă. Este folosit să furnizeze curent electric făcând transferul de electroni printr-o reacție redox. A galvanic celula este o idee exemplară a modului în care energia poate fi valorificată folosind reacții simple între câteva elemente date.
Doar așa, de ce există 2 jumătate de celule într-o celulă electrochimică?
Celule electrochimice constau de obicei din doua jumatati - celule . Jumatatea - celule separa cel oxidare jumătate -reacție de la cel reducere jumătate -reacție și fac posibilă trecerea curentului printr-un fir extern. Reducerea are loc la cel catod. Se finalizează adăugarea unui pod de sare cel circuit care permite curgerea curentului.
Care sunt cele două tipuri de celule electrochimice?
Doua tipuri de Celulă Sunt Două fundamental tipuri de celule electrochimice : galvanic și electrolitice. Celulele galvanice transformă energia potențială chimică în energie electrică. Conversia energiei se realizează prin reacții redox spontane (ΔG < 0) producând un flux de electroni.
Recomandat:
Care sunt cele două componente ale ADN-ului afișate în gadget?

Cele două componente ADN care sunt afișate în Gizmo includ fosfați și nucleozide
Cum diferă forma unei celule vegetale de cea a unei celule animale?
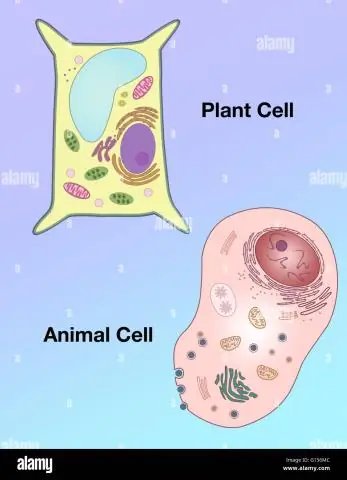
Vacuole: Celulele vegetale au o vacuola mare, în timp ce celulele animale conțin mai multe vacuole mici. Forma: Celulele vegetale au o formă mai regulată (în general dreptunghiulară), în timp ce celulele animale au forme neregulate. Lizozomi: sunt prezenți în general în celulele animale, în timp ce sunt absenți în celulele vegetale
Care sunt cele 3 componente ale studiului populației?

Studiul demografiei constă practic din trei componente: mortalitatea, fertilitatea și migrația, dar numai primele două au primit multă atenție în studiile moderne ale lumii antice
Care sunt cele cinci componente ale circuitului de bază, care sunt unitatea lor?

Acestea sunt cele mai comune componente: Rezistoarele. Condensatoare. LED-uri. Tranzistoare. Inductori. Circuite integrate
Care sunt cele 2 componente ale litosferei?

Litosfera este formată din roci din două dintre straturile majore ale Pământului. Conține toată învelișul exterior, subțire al planetei, numită crustă, și partea superioară a stratului următor inferior, mantaua
