
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Modificat ultima dată 2025-01-22 17:08.
Clorul izotop cu 18 neutroni are o abundență de 0,7577 și un număr de masă de 35 amu. Pentru a calcula in medie masa atomică, înmulțiți fracția cu numărul de masă pentru fiecare izotop , apoi adaugă-le împreună.
În mod similar, care este media ponderată a tuturor izotopilor unui element?
Folosind masele diferitelor izotopi și cât de abundent fiecare izotop este, putem găsi in medie masa atomilor lui an element . Masa atomică a unui element este medie ponderată masa atomilor dintr-o probă naturală a element . Masa atomică este de obicei raportată în unități de masă atomică.
ce are masa de 1 amu? O unitate de masă atomică (simbolizată AMU sau amu) este definită ca exact 1/12 din masa unui atom de carbon-12. Atomul de carbon-12 (C-12) are șase protoni și șase neutroni în nucleul său. În termeni impreciși, o AMU este media proton masa de repaus si cel neutroni masa de repaus.
În al doilea rând, cum se calculează procentul de abundență folosind masa atomică?
Schimbați fiecare abundență procentuală în formă zecimală prin împărțirea la 100. Înmulțiți această valoare cu masă atomică a acelui izotop. Adunați împreună pentru fiecare izotop pentru a obține media masă atomică.
Care este diferența dintre masa atomică și greutatea atomică?
Masă atomică (mA) este masa a unui atom . Un singur atom are un număr stabilit de protoni și neutroni, deci masa este fără echivoc (nu se va schimba) și este suma numărului de protoni și neutroni în atom . Greutate atomica este o medie ponderată a masa dintre toate atomi a unui element, pe baza abundenței izotopilor.
Recomandat:
Cum găsiți greutatea specifică a unui amestec lichid?

Acum împărțiți densitatea totală la densitatea apei și obțineți SG al amestecului. Care este lichidul cu cea mai mare densitate? Când se amestecă un volum egal a două substanțe, greutatea specifică a amestecului este 4. O masă a unui lichid cu densitatea p este amestecată cu o masă egală a unui alt lichid cu densitatea 3p
Cum interpretezi media ponderată?

Rezumat. Medie ponderată: o medie în care unele valori contribuie mai mult decât altele. Când ponderile se adaugă la 1: doar înmulțiți fiecare greutate cu valoarea potrivită și însumați totul. În caz contrar, înmulțiți fiecare greutate w cu valoarea ei de potrivire x, însumați toate acestea și împărțiți la suma greutăților: Media ponderată = ΣwxΣw
Cum găsiți forma componentei unui vector având în vedere mărimea și unghiul?
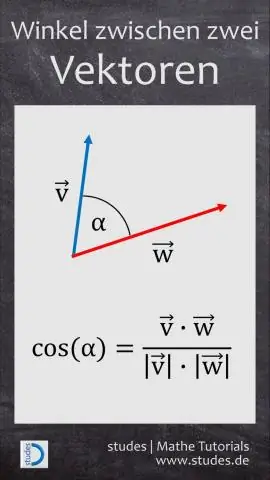
VIDEO Ținând cont de acest lucru, este 0 un vector unitar? A vector unitar este o vector care are o magnitudine de 1. Notația reprezintă norma, sau mărimea, a vector v. De bază vectori unitari sunt i = (1, 0 ) și j = ( 0 , 1) care au lungimea 1 și au direcții de-a lungul axei x pozitive și, respectiv, a axei y.
Cum se creează o medie ponderată într-un tabel pivot?

Medii ponderate într-un tabel pivot Faceți clic pe săgeata în jos de lângă cuvântul PivotTable din partea stângă a barei de instrumente PivotTable. Alegeți Formule | Câmpuri calculate. În caseta Nume, introduceți un nume pentru noul câmp. În caseta Formulă, introduceți formula pe care doriți să o utilizați pentru media ponderată, cum ar fi =WeightedValue/Weight. Faceți clic pe OK
Cum găsiți media și mediana în tablou?
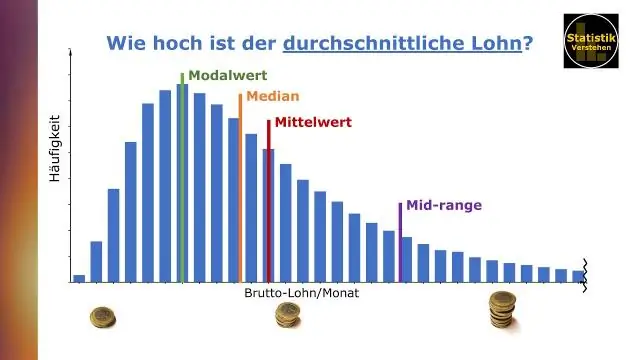
Comunicarea datelor cu Tableau de Ben Jones Media (sau media) este determinată prin însumarea tuturor valorilor dintr-un set de date și împărțirea la numărul de valori. Mediana este valoarea de mijloc dintr-un set de date în care valorile au fost plasate în ordinea mărimii
