
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Modificat ultima dată 2025-01-22 17:08.
Să luăm un exemplu de a tampon formată din baza slabă amoniac , NH3 și acidul său conjugat, NH4+. Cand acid clorhidric La aceasta se adaugă (acid puternic). tampon sistem, ionii H+ suplimentari adăugați în sistem sunt consumați de către NH3 la formă NH4+. Adăugarea suplimentară a unui acid sau a unei baze la tampon își va schimba rapid pH-ul.
De asemenea, este nh3 și NH4Cl o soluție tampon?
Răspuns și explicație: amoniac și clorură de amoniu tampon este un amestec de acid slab și sarea acestuia. Este o bază tampon deoarece constanta de disociere a bazelor pentru amoniac este mai mare decât constanta acidă pentru ionii de amoniu.
La fel, ce tip de reacție este HCl și nh3? Prin urmare NH3 la primirea H+ de acid clorhidric (H+ și Cl-) formează NH4+ (ion de amoniu) care la legarea cu ionul Cl- (din acid clorhidric ) dă NH4Cl (clorură de amoniu). The reacţie este reprezentat ca NH3 + acid clorhidric = NH4CI.
De asemenea, întrebarea este, ce reacție are loc atunci când HCI este adăugat la tamponul de amoniac?
Cel clorhidric acid ar reacționa violent cu amoniacul pentru a forma clorură de amoniu (care este o sare foarte ușor acidă, în general inofensivă), neutralizând bazicitatea soluției și s-ar observa formarea viguroasă a bulelor de hidrogen gazos, ca efuziune a soluției.
Cum se face o soluție tampon de amoniac?
Amoniac -Clorură de amoniu Tampon : Se dizolvă 67,5 g de clorură de amoniu în aproximativ 200 ml de apă, se adaugă 570 ml de soluție de amoniac și se diluează cu apă la 1000 ml. Tampon de amoniac pH 9,5: se dizolvă 33,5 g de clorură de amoniu în ISO ml de apă și 42 ml de 10M amoniac și se diluează cu apă la 250 ml.
Recomandat:
Care soluție este un tampon?

O soluție tampon este una care rezistă la schimbările de pH atunci când i se adaugă cantități mici de acid sau alcali. Soluții tampon acide. O soluție tampon acidă este pur și simplu una care are un pH mai mic de 7. Soluțiile tampon acide sunt de obicei făcute dintr-un acid slab și una dintre sărurile sale - adesea o sare de sodiu
Care este sistemul tampon principal din sânge?

Sânge. Sângele uman conține un tampon de acid carbonic (H 2CO 3) și anion bicarbonat (HCO 3 -) pentru a menține pH-ul sângelui între 7,35 și 7,45, deoarece o valoare mai mare de 7,8 sau mai mică de 6,8 poate duce la moarte
De ce funcționează cel mai bine un tampon la un pH aproape de pKa?
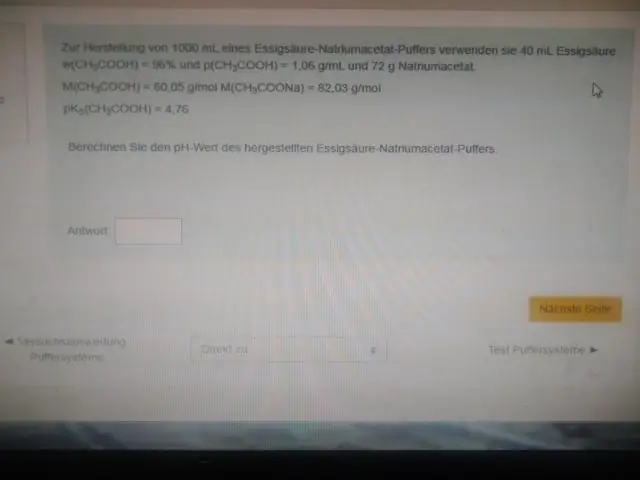
Cu alte cuvinte, pH-ul soluției echimolare de acid (de exemplu, când raportul dintre concentrația acidului și a bazei conjugate este 1:1) este egal cu pKa. Această regiune este cea mai eficientă pentru a rezista la schimbări mari de pH atunci când se adaugă acid sau bază. O curbă de titrare demonstrează vizual capacitatea tampon
Cum se face un tampon carbonat bicarbonat?

Rețetă și preparare Tampon carbonat-bicarbonat (pH 9,2 până la 10,6) Se prepară 800 mL de apă distilată într-un recipient adecvat. Se adaugă 1,05 g de bicarbonat de sodiu în soluție. Se adaugă 9,274 g de carbonat de sodiu (anhidru) la soluție. Adăugați apă distilată până când volumul este de 1 L
Care este intervalul de pH al majorității sistemelor tampon?

Există o varietate de sisteme de tamponare în organism care ajută la menținerea pH-ului sângelui și al altor fluide într-un interval îngust - între pH-ul 7,35 și 7,45. Un tampon este o substanță care previne o schimbare radicală a pH-ului fluidului prin absorbția excesului de hidrogen sau ioni de hidroxil
